前回までの復習

前回に引き続き、原子と周期表の解説をしていきましょうか。

前回勉強した内容は覚えていますか?

覚えてるよ!2割くらいは!

10割覚えててください。簡単に前回の内容をおさらいしましょう。

あーね!なんかやったね!

周期表の同じ縦列の原子は似た性質を持ってる原子である可能性が高いという話がありました。

その中でヘリウム、ネオン、アルゴンという3つの原子に触れましたね?

↑アルゴンの原子番号が20番になってるけど、正しくは18番だよ!by犬星さん

たしか、非常に安定していて、化学反応を起こしにくい気体っていう性質があるんだよね?

よく覚えていますね。一番右側の列、『希ガス』と呼ばれる原子の特徴です。
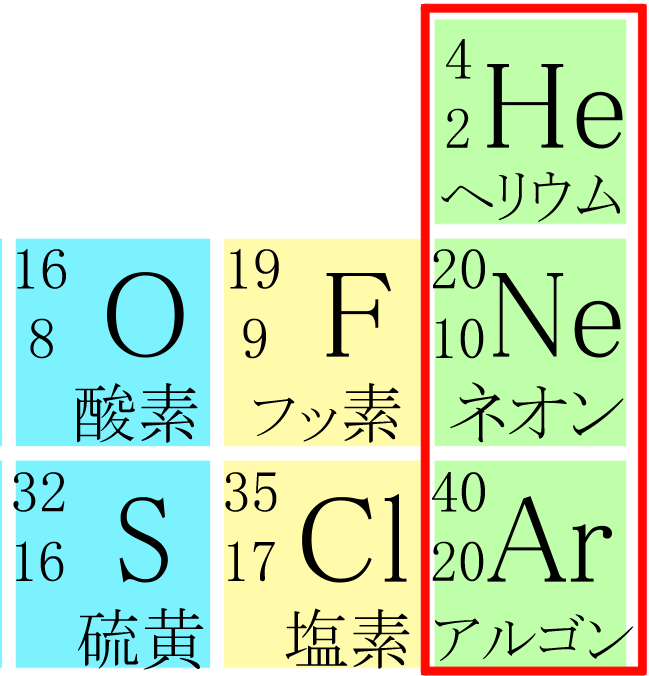
↑アルゴンの原子番号が20番になってるけど、正しくは18番だよ!by犬星さん

では、何故同じ縦列の原子には、同じ性質の原子が多いのでしょうか。

というのが、前回未解決だった疑問でしたね

そうなんだ

そうです。これを説明するには、結合と最外殻電子について理解する必要があります
結合と最外殻電子

さ、最外殻電子ィ!!
うわぁ、難しそうなの出てきたぁあ!おしまいだぁ!

いえ、そんな事はありません。
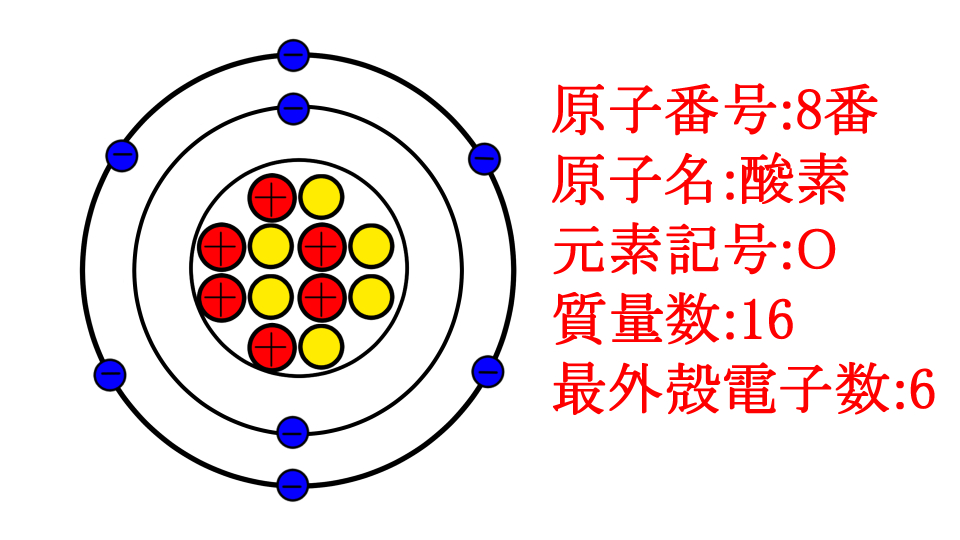
まず最外殻電子についてですが、これは単に1番外側の層の電子の数だと思ってください

じゃあ、左から何番目の原子かって考えればOK?

はい。例えば、原子番号8番の酸素であれば、右から6番目の列なので、最外殻電子は6個です。

1列目の層が満杯まで詰まってるからね!


続いて、結合についてです。

この世の全ての物質は原子でできているのは、言うまでもありませんよね?

うん。そうだね。

結合というのは、原子同士が結びついて合体するみたいなイメージです。

水も空気も、全部この原子が結合して集まる事でできてるんだよね!


…

ん?どうした?

おかしいですよね?

うん?なにが?

プラスとマイナスは引き寄せ合い、プラス同士、マイナス同士では反発する。

はい、復唱してください。

プラスとマイナスは引き寄せ合い、プラス同士、マイナス同士では反発する。

はいじゃあ、試しに原子を2つ並べて結合させてみましょう。
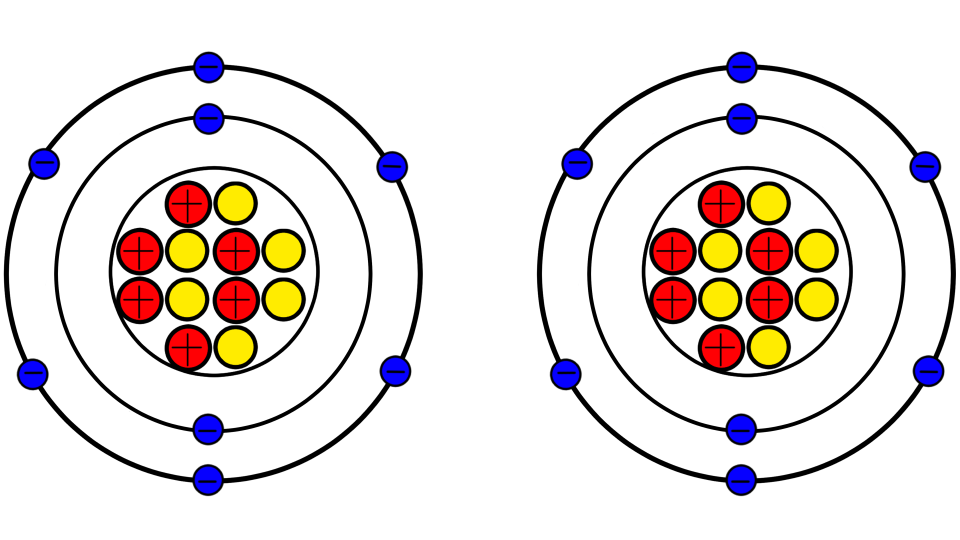

うん。これがどうかしたの?

はい、マイナス同士は?

反発する。

あれ…?


反発して結合できないじゃん!!世の中の常識は間違っていたんだ!!

間違ってないです。

という事で、次は共有結合とイオン結合と題しまして、
結合について詳しく見ていきましょう

の前に、1つ覚えておいて欲しい事があります

なんで1回フェイント挟んだ?

最外殻電子は8個、つまり満杯まで詰まっている状態が最も安定しているという事です。

じゃあ、希ガスが安定してるって事だね!

その通りです。
共有結合とイオン結合

とりあえず、こちらを見てください
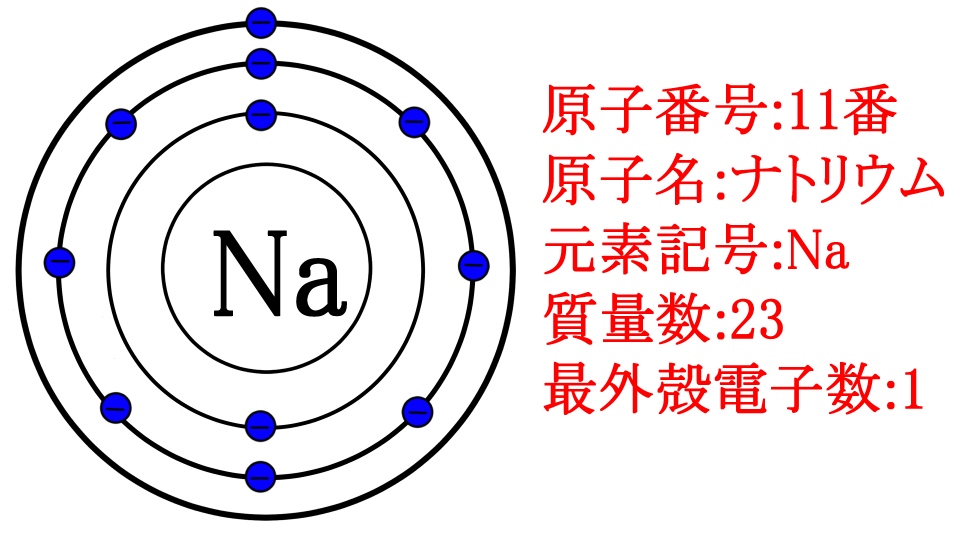

電子の層が3つあって、最外殻電子電子が1つだから、3列目の1番目だから、ナトリウムだね!

正解です。さて、前述の通り、最外殻電子は0個が最も安定しています

なので、この余ってる電子がどうにも邪魔になります。そこで、このナトリウムは思うわけです

ああ、自分とは逆に電子が足りない原子がいれば、この余ってる電子をあげられるのにな〜

どこかに最外殻電子があと1個で満杯になる原子いないかな〜

いないかな〜!いないかな〜!

おや、偶然こんな所に原子番号17番の塩素がいますね。

しかも、塩素の最外殻電子は7個。ちょうど電子があと1個あれば、層が満杯になります
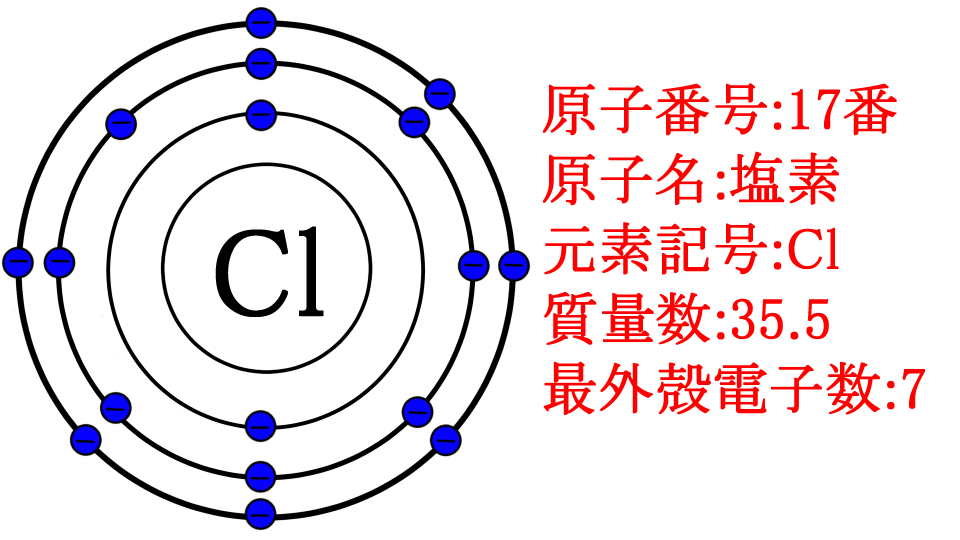

わー!凄い偶然!

という事で、ナトリウムの余ってる電子を、塩素にあげちゃいましょう
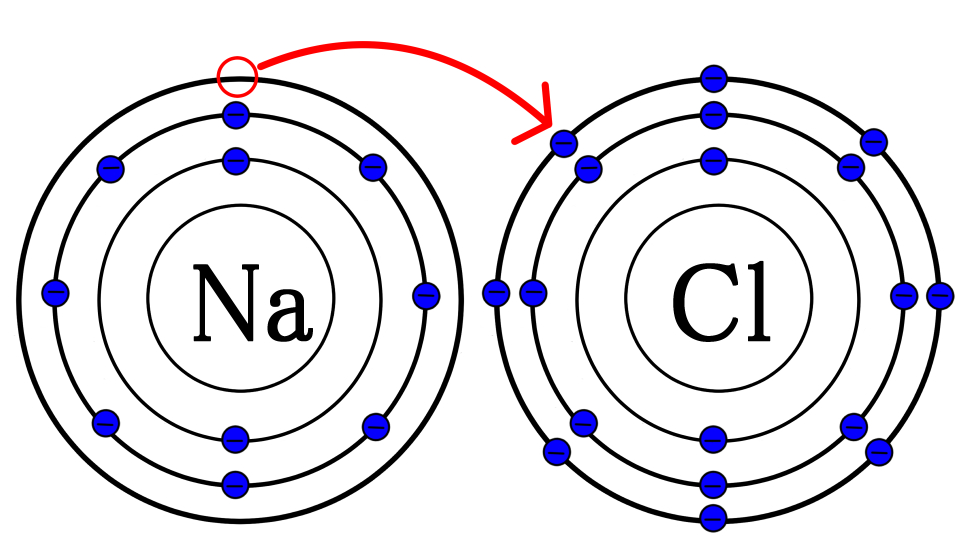

これでナトリウムも塩素も、最外殻電子が0個になりましたね。

では姉さん、ここで2つの原子の電荷を見てみましょう

たしか、陽子がプラスで電子がマイナスなんだよね?

あれ、ナトリウムは塩素に、電子を1個あげちゃってるから、陽子と電子の数がイコールにならないよ!

はい、つまり電荷の偏りが発生してしまいますね
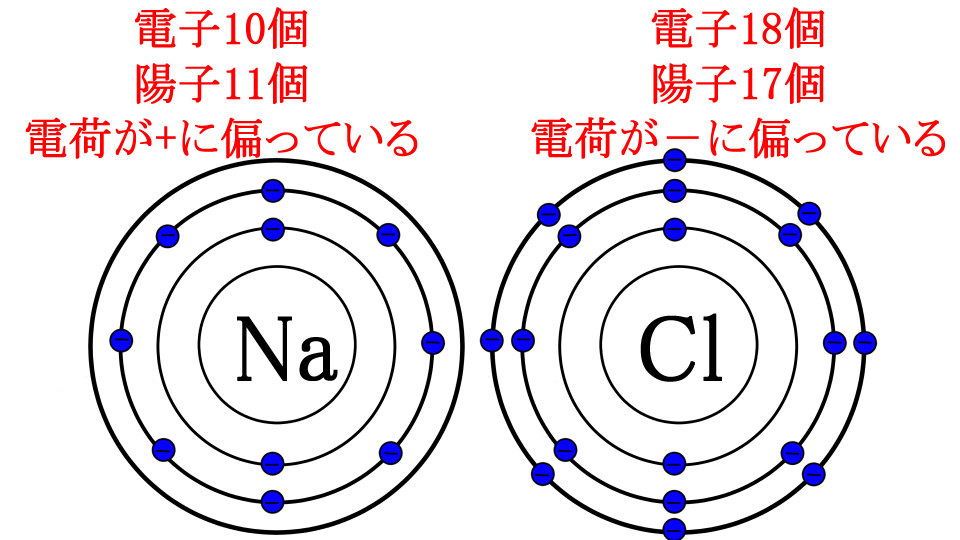

ナトリウムは電子(マイナス)が減っているのでプラスに偏っています

マイナス×マイナスはプラスになるもんね!

塩素はマイナスが増えているのでマイナスに偏っています

つまり、わかりやすくするとこういうことですね
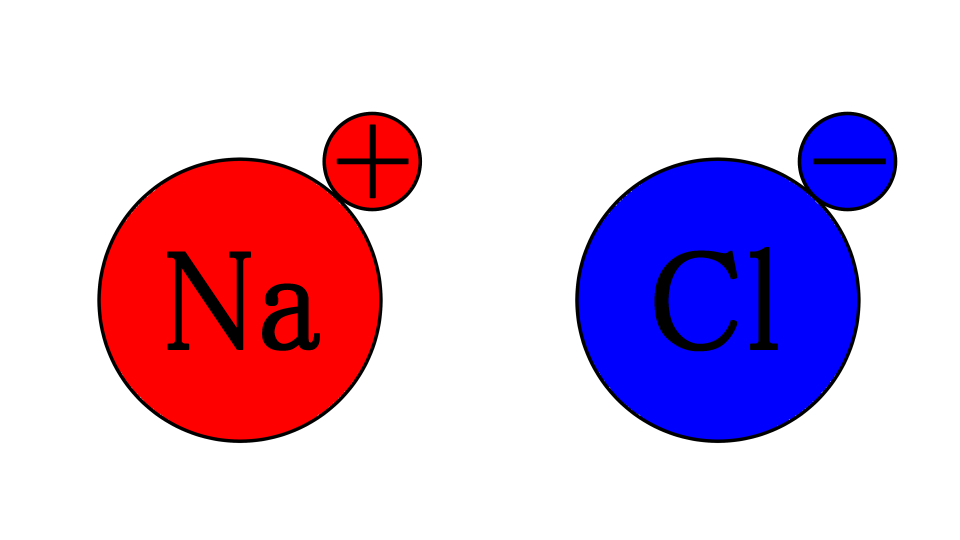

ところで姉さん、プラスとマイナスは?

引き寄せ合う!!
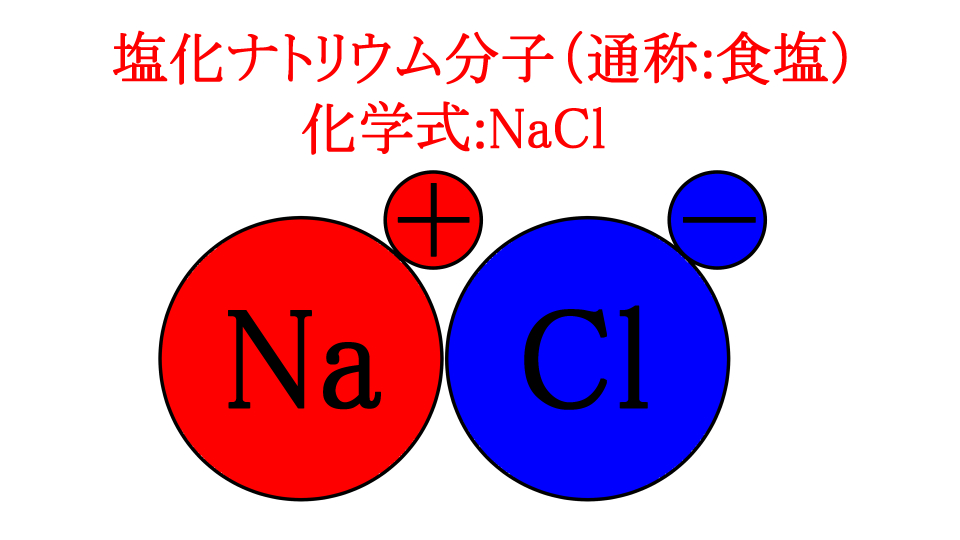

はい、これがイオン結合ですね

さて続いて、共有結合についてです。例として、2つの酸素が出会ったパターンで考えてみましょう。

酸素は原子番号8番で、最外殻電子は6個で、電子が2個足りない原子でしたね


『共有』結合って言うからには、足りない同士で電子を共有するって事かな?

その通りです。下の画像のように足りない同士で1個ずつ電子を出し合って、空いてる部分を埋めます
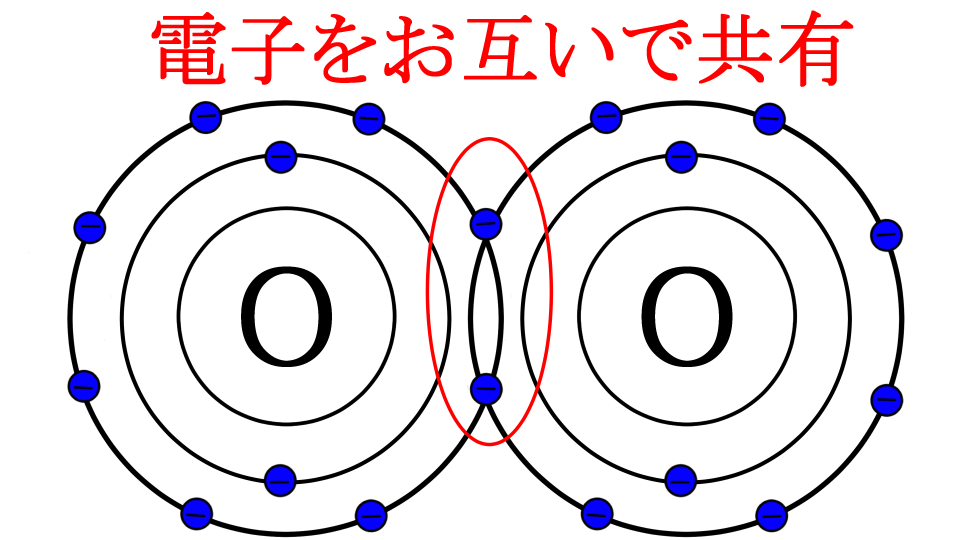

でもさ、マイナス同士で反発して結合できないんじゃないの?

イオン結合はプラスとマイナスで引き寄せ合うから納得できるんだけど…

それは単純に酸素が不安定な原子だからです。つまり、どうしてもあと2個電子が欲しいのです。

マイナス同士で反発してても、それを無視できちゃうくらい電子が欲しいって事?

イメージとしては、めっちゃ電子が欲しい2つの酸素が出会って、電子を奪おうとお互いに引き寄せ合います

その結果、2つの酸素が合体してしまったという感じでしょうか
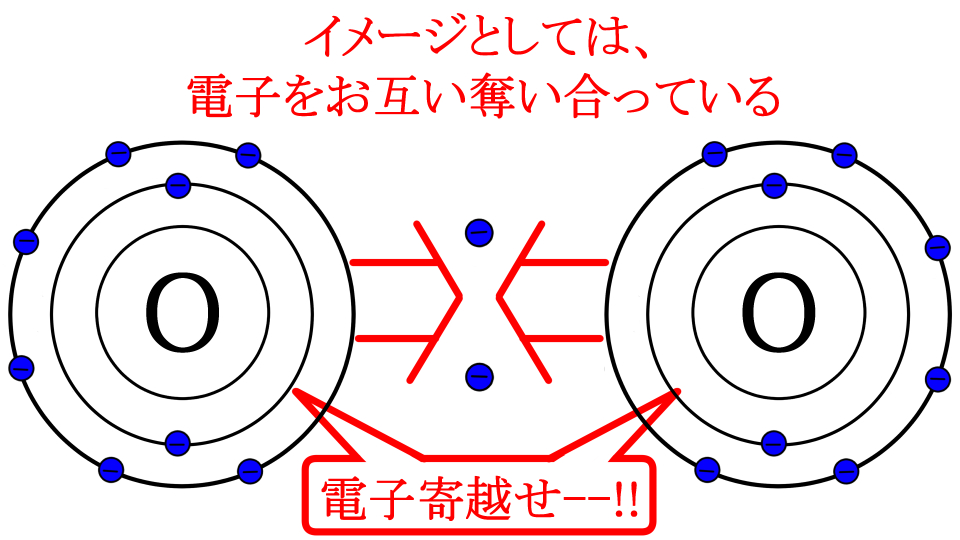

合体♂♀しちゃったわけだね!

いえ、同じ酸素同士なので合体♂♂ですね。

オーマイガー!めっちゃギャラクシー!

どっから出てきたんですか、そのギャラクシーは。

それはともかく、イオン結合と共有結合については理解できましたね?

できた〜!2割くらい!

10割理解してください。

さて、第1回の原子と周期表も残すところ僅かです
次は遂に、原子に周期的な性質が表れる理由を解説します。
原子の周期性

と言っても、もうほとんど答えは出ていますよね。
原子に現れる周期性は最外殻電子数によるものです

先程の結合の話ですが、イオン結合は電子が欲しい原子と、余ってる電子による結合でした

共有結合は電子が足りない原子同士の結合だったよね?

ちなみに、電子が余ってる同士は結合できないって事?

まあ、実はできるたりする場合もあるんですが、それはまた後々やります。

ともあれ、どのような原子と結合しやすいか、というのは最外殻電子に依存しているという事です

つまり、最外殻電子の数が同じであれば、同じ原子と反応しやすいという事になります。

これが、原子に周期性の正体です

なーほーね?

同じ原子と結びついたら、似た性質になるのは納得だね!

まとめるとこんな感じかな

100点満点です

やったぜ!

という事で、全ての疑問が解決しましたね。
最後に族について簡単に説明してまとめに移りましょう。
周期表の族

あーね。族ね。わかるわかる。

貴族とか王族とかね。なろう小説でよく出てくるやつね。

違います。一言で言うと、周期表で同じ縦列の原子、つまり似た性質の持つ原子にまとめて名前を付けたものです。

度々名前の出ていた『希ガス』というのも、この族の1つです

希ガスが安定しているのは、最外殻電子が満杯なので、他の原子と反応しにくいからですね。

最外殻電子数が同じ=周期表で同じ縦列=似た性質を持っている=同じ族の原子って認識でオーケー?

まあ、例外は除くという但し書きは必要ですが問題ありません。

希ガス以外にも幾つか覚えておいて欲しい族があります

えー、暗記きらーい!

こればっかりは仕方ないです。でも、希ガスを除けば3種類だけですので。

まあ、3つだけなら覚えてやらん事もないな!

何様ですか。まあ、暗記は法令で嫌という程してもらいますので

え…?


ではまずは、希ガスの隣の列『ハロゲン』です。

電子があと1個で満杯になるので、他の原子から電子を奪いやすいという性質があります。

消化剤なんかに使われたりします

続いて真反対、一番左側の列は『アルカリ金属』です。ただし、水素は除きます

水素は仲間外れ?生真面目で空気読めなくて、周りと馴染めない妹ちゃんとおなじだね

まあ、水素は金属じゃないので。あと、辞書の角で殴りますね

暴力!暴力振るったよ今!

そうですね。アルカリ金属はハロゲンと逆に原子が1つ余ってるので、電子を押し付けようとする性質があります

あと、どうでもいいですが、水に入れると爆発します

どっかーーん!

最後はその右隣、左から2列目の『アルカリ土類金属』です。

同様に電子が余ってるので、押し付けようします。

何故に土類が付いた?

ざっくり言うと、酸素と結合した際に、土に似た性質を示すからです。

へぇー、よくわかんね

はい、以上の『希ガス』『ハロゲン』『アルカリ金属』『アルカリ土類金属』が覚えて欲しい族です。

ちなみに、別に呼び方として、『18族元素』『17族元素』『1族元素』『2族元素』と表現する場合もあります。これは左から何列目での呼び方ですね
まとめ

という事で、乙4解説第1回はこれで終了となります。姉さん、どうでしたか?理解できましたか?

うん!2割くらいは!

完璧みたいですね。次の第2回はおそらく多分きっと『物質の三態』か『電気と静電気の違い』か『金属結合』か『熱の正体』のどれかをやると思います

曖昧すぎる〜!

あと最後に、前回と今回の解説のまとめを載せておきますね


コメント